국내개발 신약과 바이오시밀러는 꾸준한 발전
[헤럴드경제=함영훈 기자] 고령화 사회로의 진전이 빨라지면서 여러 질환을 한꺼번에 다스리는데 도움을 주는 복합제 개발이 크게 늘어난 것으로 나타났다.
 |
| 2016년 활기를 띠다 2017년 다소 주춤하던 의약품 개발 신고·허가가 2018년 다시 상승세를 탔다. 식품의약품안전처(처장 이의경) 집계 결과, 연도별 국내 허가·신고 품목수는 2016년 3828개→2017년 2524개→2018년 2482개였다. |
18일 식약처에 따르면, 지난해 2482개 의약품이 허가·신고됐으며, 이 중 국내 개발 복합제 101개 품목이 허가되어 2017년(48개 품목)에 비해 2배 이상(114.8%) 증가한 것으로 집계됐다. 고혈압-고지혈-당뇨 복합제 개발이 많았다.
식약처 담당관은 “지난 2017년 우리나라가 65세 이상 연령층이 전체 인구의 14%를 초과하는 ‘고령 사회’로 진입하면서, 만성질환 유병률이 증가하고 있어, 여러 종류의 약을 한 번에 복용할 수 있는 복합제 개발이 크게 늘어난 때문인 것으로 보인다”고 밝혔다.
연도별 국내에서 개발된 복합제 품목수(전체/국내개발)는 2016년 86/71개, 2017년 55/48개, 18년 111/101개이다.
식약처는 지난해 의약품 허가‧신고 현황의 주요 특징과 관련, ▷국내 개발 복합제 증가 ▷제네릭의약품 허가 약세 ▷해열·진통·소염제 등 신경계용의약품의 약효군별 허가·신고품목 1위 등극이라고 설명했다.
지난해 허가·신고된 완제의약품(2046개 품목)을 제품 특성에 따라 분류하면, 화학의약품 1886개 품목, 생물의약품 28개 품목, 한약(생약)제제 132개 품목이다.
화학의약품은 신약 11개 품목, 자료제출의약품 239개 품목(개량신약 6개 품목 포함), 희귀의약품 11개 품목, 제네릭·표준제조기준 등에 따른 의약품 1625개 품목이 허가됐다.
자료제출의약품이란 신약이 아닌 의약품이면서 ‘의약품의 품목‧허가‧심사 규정’에 의한 안전성‧유효성 심사가 필요한 품목을 말한다. 자료제출의약품 중 새로운 조성의 복합제(111개 품목, 46.4%)의 국내 개발이 특히 두드러졌는데, 대부분 만성질환(고혈압, 고지혈증, 당뇨병 등) 치료제가 대부분을 차지했으며, 최근에는 3개 성분으로 구성된 고혈압·고지혈증 복합제 허가도 꾸준히 강세를 보이고 있다.
제네릭의약품(복제약)은 제네릭 난립에 대한 규제 정책이 예고되면서 둔화세를 보였다. 지난해 제네릭의약품 허가는 982개 품목으로 2017년(954개 품목)과 비슷했다. 2016년에 비해 지난해 약품 개발 수가 크게 줄었기때문에 기저효과를 감안하면 제네릭 개발 의지가 위축됐다는 해석이 가능하다. 또 2018년 특허가 만료되는 의약품의 시장규모가 크지 않고, 특허 회피 전략을 보다 세밀하게 짠 것도 요인으로 작용했다. 연도별로는 2016년 1615개, 2017년 954개, 2018년 982개이다.
지난해 허가‧신고된 완제의약품을 약효군별로 분류하면 해열·진통·소염제 등이 포함된 신경계용의약품이 399개 품목(19.5%)으로 가장 많았다.
이어 혈압강하제 등 순환계용의약품 354개 품목(17.3%), 기타의 대사성의약품 및 당뇨병용제 214개 품목(10.5%), 소화기관용의약품 183개 품목(8.9%), 외피용약 117개 품목(5.7%), 항생물질제제 102품목(5.0%), 호흡기관용의약품 91개 품목(4.4%), 화학요법제 77개 품목(3.8%) 등의 순이었다.
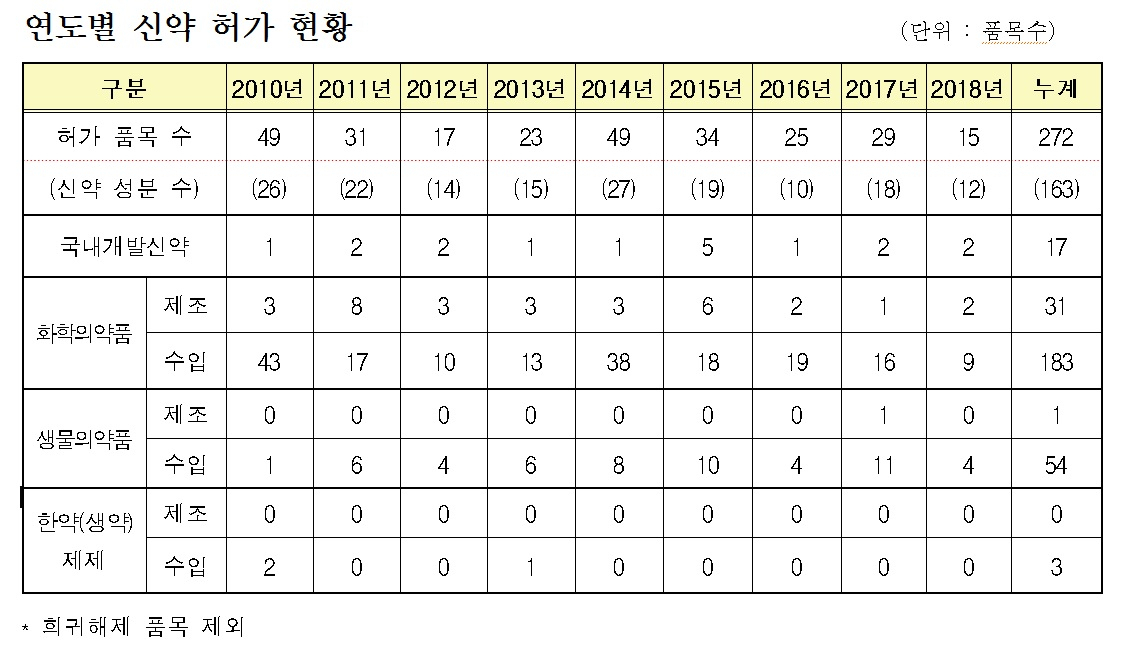
지난해 허가된 신약(15개 품목) 중 국내개발 신약은 2개 품목, 수입 신약은 13개 품목이었으며, 종류별로는 화학의약품 11개, 생물의약품 4개 품목이었다.
지난해 신약 허가 건수는 다소 감소하는 추세였으나, 국내개발 신약과 바이오시밀러는 꾸준한 경향을 보이는 것으로 나타났다.
연도별 국내개발 신약 허가는 2016년 1개·1성분, 2017년 2개·2성분, 2018년 2개·2성분이다.
수입신약은 2016년 23개·9성분, 2017년 27개·16성분, 2018년 13개·10성분이다.
국내개발 바이오시밀러 허가는 2016년 1개·1성분, 2017년 2개·2성분, 2018년 7개·2성분이다.
화학의약품 중 국내개발신약(2개 품목)은 알츠하이머 보조진단용 방사성의약품과 위식도역류질환 치료제가 각각 1개 품목이 허가됐고, 수입신약(9개 품목)은 C형 간염치료제, 외피용 소독제, 진토제, 당뇨병용제, 화학요법제 등 다양한 약효군을 보였다.
생물의약품 모두 수입신약(4개 품목)으로 아토피피부염, 단장 증후군과 같이 생물의약품으로서는 기존에 허가된 바 없는 새로운 효능·효과를 가진 신약도 허가됐다.
식약처는 국내 의약품 연구·개발에 도움을 주고자 매년 ‘의약품 허가보고서’를 발간하고 있으며, 앞으로도 국내 의약품 허가·신고 현황과 분석 정보를 지속적으로 제공하겠다고 밝혔다. 자세한 내용은 식약처 홈페이지(www.mfds.go.kr)〉법령·자료〉자료실〉매뉴얼/지침에서 확인할 수 있다.
abc@heraldcorp.com








